《药品不良反应/事件报告表》填写要求
日期: 2009-05-21
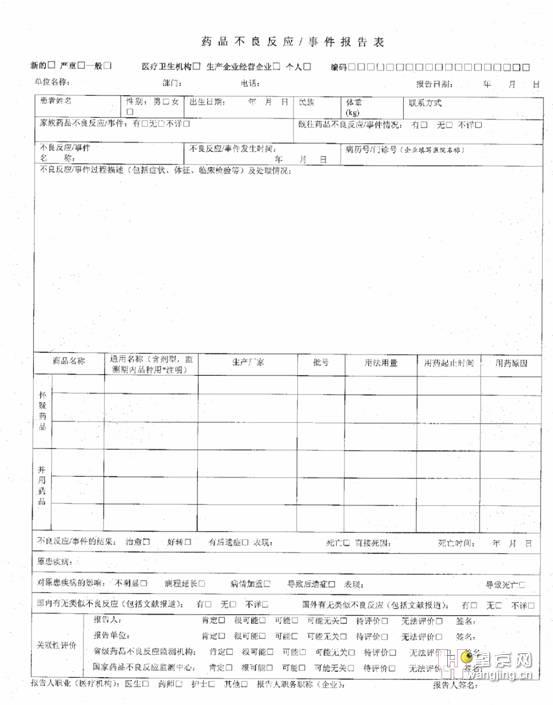
本院《药品不良反应/事件报告表》填写要求
《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,需要永久保存,务必要用钢笔或签字笔填写。填写的内容和字迹要清楚、整洁;不用不规范的符号、代号,不用草体签名。报告表中选择项划√,叙述项应准确、简明。
每一个患者填写一张报告表。尽可能详细填写所有项目。无法获得的项目,填写“不详”。空间不够时可附页,注明“附件”。所有附件应按顺序表明页码,并指出所描述的项目的名称。
填写详细要求:
(1) 新的□ 严重□ 一般□
“一般”是指新的、严重的药品不良反应以外的所有药品不良反应。“新的”可与“严重”或“一般”复选,而“严重”与“一般”只能二选一。
药品严重ADR是指因服用药品引起以下损害情形之一的反应:
1)引起死亡;
2)致癌、致畸、致出生缺陷;
3)对生命有危险并能够导致人体永久的或显著的伤残;
4)对器官功能产生永久损伤;
5)导致住院或住院时间延长。
(2)编码
编码为各级药品不良反应监测机构在网络报告时自动生成,不用填写。
(3)单位名称
填写发现并报告药品不良反应的单位名称,要求填写全称:北京市朝阳区望京社区卫生服务中心。
(4)部门
部门应填写科室名称,如“病房”或 “眼科”。
(5)电话
电话号码应填写报告部门电话,注意填写区号,如010-64750202。
(6)报告日期
报告日期应为填写此报告的日期,不是不良反应发生的日期。
(7)患者姓名、性别、民族
填写患者真实全名、性别、民族。
(8)出生日期
填写患者的出生日期。如无法获得准确日期,应根据发生药品不良反应时的年龄推断准确年份,月份和日填写1月1日,如1940年1月1日。
(9)体重
注意以千克(公斤)为单位,如果不知道准确的体重,请做一个最佳的估计。
(10)联系方式
最好填写患者的联系电话或者移动电话。
(11)家族药品不良反应/事件
根据实际情况在相应方框填入√,不应使用×等其它标志,避免理解偏差。病人家族成员如有不良反应史可详细注明为何不良反应。
(12)既往药品不良反应/事件情况
既往药品不良反应/事件情况包括药物过敏史。如有不良反应史可详细注明。
(13)不良反应/事件名称
不良反应/事件名称应填写不良反应中最主要的表现。例如:不良反应表现:患者从Ⅹ年Ⅹ月Ⅹ日开始使用Ⅹ,1次/日,静滴,两天后患者胸腹部出现斑丘疹,有瘙痒感。继续使用后丘疹面积增大。不良反应名称可填写瘙痒、斑丘疹。对于临床医生来说,不良反应/事件名称相当于病历中的主诉,为病人感受最主要的疾苦或最明显的症状和体征。不良反应/事件名称的选取参考《WH0药品不良反应术语集》。
(14)不良反应/事件发生时间
填写不良反应发生的确切时间。
当一个新生儿被发现有出生缺陷,不良反应/事件的发生时间就是孩子的出生日期。
当一个胎儿因为先天缺陷而发生早产或流产时,不良反应/事件的发生时间就是怀孕终止日期。
(15)病历号/门诊号
认真填写患者的病历号(门诊号)以便于对病历详细资料的查找。如无病历号,可填写“门诊手册”。
如病人是在其他医院用药后发生的不良反应,来我院就诊,在此栏同时填写病例发生医院的名称和病历号。
(16)不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况
在填写不良反应/事件的开始时间和变化过程时,要用具体时间,如X年X月X日,不要用“入院后第X天”,“用药后第X天等”。
在填写不良反应/事件的过程时,要求摘要描述。在描述不良反应/事件的表现时要尽可能明确、具体,如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心律失常,要填写何种心律失常;如为上消化道出血,有呕血者需估计呕血量的多少等。与不良反应/事件有关的临床检验结果要尽可能明确填写,如怀疑某药引起血小板减少症,应填写病人用药前的血小板计数情况及用药后的变化情况,如怀疑某药引起药物性肝损害,应填写用药前后的转氨酶水平,同时要填写肝炎病毒学检验结果,所有检查要注明检查日期。
此外,应注意填写与不良反应/事件发生有关的患者病史,如:
① 高血压、糖尿病、肝/肾功能障碍等
② 过敏史、怀孕史、吸烟史、饮酒史、药物滥用史等
不良反应的处理情况,填写本次发现的不良反应/事件的处理情况,主要针对不良反应/事件而采取的医疗措施,包括为分析因果关系而采取的措施和相应结果,如补做皮肤实验的情况。
(17)怀疑药品
这一栏主要填写填表人认为可能是引起不良反应/事件的药品,如认为多种药品均可能,可将情况同时填上。如果有四个以上的怀疑药品(含四个),可另附纸说明。如果报告人认为药品和医疗器械都可能与不良反应/事件的发生有关,请将怀疑医疗器械填报《医疗器械不良事件报告表》,并在两张报告表中注明相关性。
商品名称:填写药品的商品名。如果没有或者不知道商品名,填写不详。
通用名称:填写完整的通用名,不可用如“氨苄”,“先V”等简称。
生产厂家:生产厂家要求填写全名(包括所在省、市),不可填“上五”、“白云”等。
批号:填写药品包装上的生产批号。
用法用量:描述患者如何使用该药品。例如:500mg每天四次口服或者l0mg隔日静脉滴注。如系静脉给药,需注明静脉滴注、静脉推注或者“小壶”给药等。对于规定要缓慢静脉注射的药品应注明是否缓慢注射。
用药起止时间:指使用药品的同一剂量的开始时间和停止时间。如果用药过程中改变剂量应另行填写该剂量的用药起止时间,并予以注明。用药起止时间大于一年时,填写XXXX年X月X日-XXXX年X月X日的格式;用药起止时间小于一年时,填写X月X日-X月X日的格式;如果使用某种药品不足一天,可填写用药持续时间。例如:一次或者静脉滴注一小时。
用药原因:应尽可能具体填写,如原患高血压性心脏病的病人,合并肺部感染而注射氨苄青霉素引起不良反应,此栏应填肺部感染。
(18)并用药品
不良反应/事件发生时,患者同时使用的其他药品或医疗器械(不包括治疗不良事件的药品),而且报告人并不认为这些药品或医疗器械与不良反应/事件发生有关。
并用药品的信息常常能够发现以前不知道的药品之间的相互作用,或者可以提供不良反应的另外的解释,故请列出与怀疑药品相同的其他信息。
如果有四个以上的并用药品(含四个),可另附纸说明。
(19)不良反应/事件的结果
系指不良反应/事件经采取相应的医疗措施后的结果,不是指原患疾病的后果。例如患者的不良反应/事件已经痊愈,后来又死于原患疾病或与不良反应/事件无关的并发症,此栏仍应填”治愈”。
不良反应经治疗后明显减轻,在填写报告表时没有痊愈,但是经过一段时间可以痊愈时,选择“好转”。
不良反应经治疗后,未能痊愈而留有后遗症时,应注明后遗症的表现。
患者因不良反应导致死亡时,应指出直接死因和死亡时间。
对于不良反应结果为有后遗症或死亡的病例,应附补充报告(病历资料)。
(20)原患疾病
即病历中的诊断,诊断疾病应写标准全称。如急性淋巴细胞白血病,不能写AIL。
(21)对原患疾病的影响
不良反应/事件对原患疾病产生的影响,依据实际情况选择。
(22)报告人职务职称(企业)
不需填写。
(23)报告人签名
报告人签名应字迹清晰,容易辨认。